Fe hóa trị mấy ?
Fe hóa trị mấy?
Trả lời: Fe có hóa trị 2 và hóa trị 3.
Như vậy, Fe có 2 hóa trị khác nhau, tùy theo phản ứng hóa học và điều kiện mà sắt sẽ cho hóa trị 2 hoặc 3.
Vì sao Fe có 2 hóa trị?
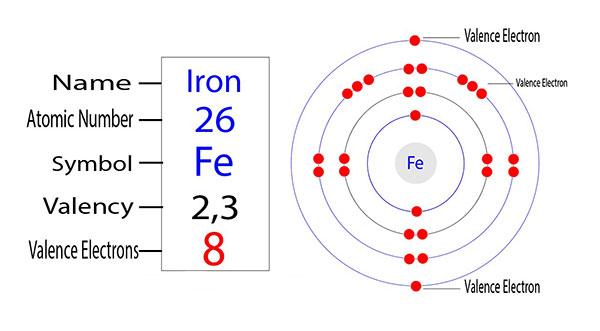
Để trả lời câu hỏi này, trước tiên chúng ta hãy xét đến cấu hình electron của sắt.
Fe có số hiệu nguyên tử là 26.
Cấu hình electron của Fe như sau: 1s2 2s2 2p6 3s2 3p6 3d6 4s2 và được viết gọn là [Ar] 3d6 4s2
Như vậy, sắt là kim loại thuộc chu kì 4, nhóm VIIIB
Hóa trị của một nguyên tố là số lượng electron mà nguyên tố đó thu được hoặc mất đi hoặc chia sẻ để đạt được cấu hình electron bền của khí hiếm… Cũng lưu ý rằng quỹ đạo 3d có 1 cặp electron, các electron còn lại chưa ghép cặp. Bởi vậy, sắt thể hiện 2 trạng thái hóa trị là +2 và +3.
- Khi mất đi 2 electron 4s thì Fe có hóa trị +2.
- Đôi khi, sắt cũng mất đi một trong các electron đã ghép cặp ở lớp 3d. Điều này khiến toàn bộ quỹ đạo 3d chứa đầy các electron chưa ghép cặp. Lúc này, hóa trị của sắt sẽ là +3.
Ví dụ một số chất mà Fe có hóa trị 2: FeO, FeSO4, Fe(OH)2
Ví dụ một số chất mà Fe có hóa trị 3: Fe2O3, Fe2(SO4)3, Fe(OH)3
Khi nào Fe có hóa trị II và khi nào có hóa trị III?
Để các em nắm chắc hơn về hóa trị của sắt trong các phản ứng hóa học, chúng ta cùng theo dõi nội dung dưới đây.
Khi nào Fe có hóa trị II?
Sắt có hóa trị II khi chúng tác dụng với các axit trung bình, axit mà gốc axit không có tính oxi hoá như HCl, H2SO4 loãng,…
Bên cạnh đó, khi cho Fe tác dụng với dung dịch muối của kim loại yếu hơn như muối đồng, muối chì hoặc muối sắt (III) hay khi cho Fe tác dụng với phi kim hoạt động trung bình yếu … thì tạo muối Fe(II).
Phương trình hóa học minh họa:
Fe + H2SO4 loãng → FeSO4 + H2
Fe + 2HCl → FeCl2 + H2
Fe + Cu(NO3)2 → Fe(NO3)2 + Cu
Fe + 2FeCl3 → 3FeCl2
Fe + S → FeS.
Khi nào Fe có hóa trị III?
Sắt có hóa trị III khi cho Fe tác dụng với các axit có tính oxi hoá mạnh như HNO3, H2SO4 đặc, nóng hoặc khi cho Fe tác dụng với những phi kim mạnh như F2, Cl2.
Phương trình hóa học minh họa:
2Fe + 6H2SO4 (đặc, nóng) → Fe2(SO4)3 + 6H2O + 3SO2
2Fe + 3Cl2 → 2FeCl3
Bên cạnh đó, hợp chất sắt (II) khi phản ứng với chất oxi hoá mạnh cũng bị oxi hoá tạo thành hợp chất sắt (III).
Phương trình hóa học minh họa:
2FeCl2 + Cl2 → 2FeCl3
2FeO + O2 → 2FeO3


